赖氨酸 L-乳酸化(lactylation) [K(L-la)] 是一种新发现的组蛋白标记,在高糖酵解条件下受到刺激,例如 Warburg 效应。K(L-la) 与广泛研究的组蛋白乙酰化不同的功能有关。虽然 K(L-la) 可以由乙酰转移酶 p300 引入,但组蛋白 去乳酰基酶(delactylases) 仍然未知。
2022年1月19日,芝加哥大学赵英明及哥本哈根大学Christian A. Olsen共同通讯在Science Advances 在线发表题为”Class I histone deacetylases (HDAC1–3) are histone lysine delactylases“的研究论文,该研究报告了锌和烟酰胺腺嘌呤二核苷酸依赖性组蛋白去乙酰酶 (HDAC) 切割 ε-N-L-乳酰赖氨酸标记的能力的系统评估。该研究在体外将 HDAC1-3 和 SIRT1-3 鉴定为去乳酰基酶。
HDAC1-3 不仅对 K(L-la),而且对 K(D-la) 和多种短链酰基修饰都表现出强大的活性。该研究进一步证实了 HDAC 1 和 3 在细胞中的 L-去乳酰基酶活性。总之,这些数据表明组蛋白乳酸化是由调节酶安装和去除的,而不是自发的化学反应。因此,该研究结果代表了朝着全面表征该途径的调节因子迈出的重要一步。

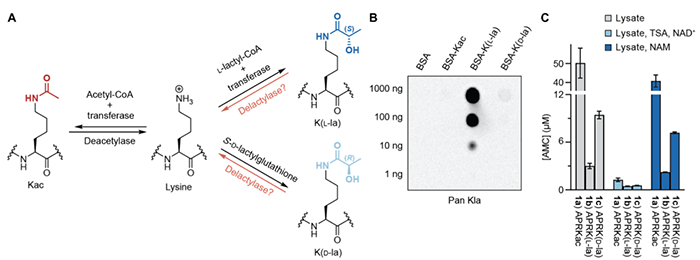
新出现的证据表明,代谢终产物和中间产物除了具有相关作用外,还具有信号功能。代谢物可以通过内在化学反应性或酶催化反应共价发挥其功能。后者的典型例子包括乙酰辅酶 A (CoA) 和 S-腺苷甲硫氨酸 (SAM),它们可分别被乙酰转移酶用于赖氨酸乙酰化和甲基转移酶用于赖氨酸甲基化。其他代谢物,例如烟酰胺腺嘌呤二核苷酸 (NAD+) 和 α-酮戊二酸,可作为辅助因子并调节相应去乙酰酶和去甲基酶的活性。 L-乳酸,传统上被称为代谢废物,最近被发现在新陈代谢中发挥重要作用。L-乳酸产生可再生细胞内糖酵解消耗的 NAD+。L-乳酸在不同器官和细胞之间的穿梭是一种主要的循环碳水化合物来源,在正常生理和癌症中起重要作用 。L-乳酸在缺氧和 Warburg 效应期间被大量诱导,这与许多细胞过程相关并且与包括瘤形成、败血症和自身免疫性疾病在内的多种疾病密切相关 。然而,L-乳酸在生理和疾病中的非代谢功能,特别是在 Warburg 效应期间,仍然很大程度上未知。L-乳酸是一种前体,可以标记和刺激组蛋白赖氨酸 ε-N-L-乳酰化 [K(L-la)] 。数据表明 L-乳酸转化为 L-乳酰辅酶 A并通过乙酰转移酶 (如 p300) 转移到组蛋白上。因此,与乙酰辅酶 A 和组蛋白赖氨酸乙酰化 (Kac) 一样,组蛋白 K(L-la) 代表了另一个例子,表明酰基辅酶 A 可以通过组蛋白翻译后修饰 (PTM) 直接影响基因表达。此外,组蛋白 K(L-la) 在糖酵解过程中具有与组蛋白乙酰化 (Kac) 不同的动力学。组蛋白 K(L-la) 由缺氧和 Warburg 效应诱导,作为一种反馈机制在巨噬细胞极化晚期促进稳态基因表达。因此,组蛋白 K(L-la) 是一种生理相关的组蛋白标记,具有独特的生物学功能。 去乳酰基酶活性的体外筛选(图源自Science Advances )除了 L-乳酸[具有 (S) 构型],其结构异构体 D-乳酸 [具有 (R) 构型] 也存在于细胞中,尽管浓度比典型的毫摩尔浓度低得多(11 至 70 nM 浓度), L-乳酸在一些癌细胞中可以达到 40 mM) 。D-乳酸主要由甲基乙二醛 (MGO) 通过乙二醛酶途径形成,并且在罕见情况下过量产生,包括某些短肠综合征病例。在这些不寻常的情况下,D-乳酸在血浆中的浓度可以达到 3 mM 或更高 。S-D-(R)-Lactylglutathione 是乙二醛酶途径中的一种中间体,可以通过非酶促反应将 K(D-la) PTM 安装在糖酵解酶上。尽管如此,有5个证据表明组蛋白是 L-乳酸化而不是 D-乳酸化:(i)前体代谢物 L-乳酸与 D-乳酸的细胞浓度存在巨大差异;(ii) 使用的抗体对 K(L-la) 的特异性(~100 倍或更高);(iii) L-乳酸可刺激和标记组蛋白乳酸化这一事实 ;(iv) 组蛋白 K(L-la) 的特定基因组定位,排除了随机、自发化学装置的可能性;(v) K(D-la) 仅富含与 S-D-乳酰谷胱甘肽密切接触的细胞溶质蛋白这一事实,而组蛋白并非如此。尽管取得了进展,但组蛋白 K(L-la) 的关键调节机制仍然未知,包括去除细胞中这种修饰的酶。哺乳动物表达两个赖氨酸去酰基酶家族,总共有 18 种酶。组蛋白去乙酰化酶(HDAC1-11,分为 I、II 和 IV 类)依赖于 Zn2+,而 sirtuins(SIRT1-7,III 类 HDAC)依赖于作为共底物的 NAD+。其中,几种同工酶对非 Kac 酰化表现出优先的酶活性。例如,SIRT5 是一种有效的赖氨酸去丙二酰化酶、去琥珀酰化酶和去戊二酰化酶,但不是去乙酰化酶,而 HDAC8、HDAC11、SIRT2 和 SIRT6 对长链酰基修饰具有显著的活性。HDAC1-3 除了具有高效的去乙酰化酶活性外,还去除 ε-N-巴豆酰赖氨酸 (Kcr) 和 ε-N-D-β-羟基丁酰赖氨酸 [K(D-bhb)] PTM 。因此,来自赖氨酸去酰基酶类的酶可能能够催化去除组蛋白乳酰基修饰。在这里,该研究报告了使用荧光团偶联肽、无荧光团组蛋白肽和提取的组蛋白作为底物对所有 18 种 HDAC 进行潜在去乳酰基酶活性的筛选。该研究表明 I 类 HDAC1-3 是体外最有效的赖氨酸去乳酰基酶,并且 HDAC1 和 HDAC3 在细胞中具有位点特异性去乳酰基酶活性。这些发现支持组蛋白 K(L-la) 修饰是一种调节和动态的表观遗传机制。HDAC1-3 在体外具有针对不同酰基赖氨酸基团的活性,包括 2 到 5 个碳的脂肪族和羟基化修饰。此外,即使在体外通过 SIRT1-3 检测到轻微的去乳酰基酶活性,泛 sirtuin 抑制剂烟酰胺 (NAM) 不影响细胞裂解物的去乳酰基酶活性或细胞中的组蛋白 K(L-la) 水平。总之,该研究数据表明 HDAC1-3 是细胞中主要的去乳酰基酶。https://www.science.org/doi/10.1126/sciadv.abi6696